Michael Palmer MD, Sucharit Bhakdi MD, Stefan Hockertz PhD
Toto odborné vyjádření předložila italská právnička Renate Holzeisenová v souvislosti se žalobou, která napadá povolení EU k používání mRNA vakcíny společnosti Pfizer u dětí od 12 let. Argumenty zde uvedené se týkají konkrétně vakcíny společnosti Pfizer, ale podobně platí i pro mRNA vakcínu Moderna a mnohé z nich se vztahují i na adenovektorové vakcíny společností AstraZeneca a Johnson&Johnson.
Tímto se uděluje povolení k volnému sdílení a šíření tohoto dokumentu v nezměněné podobě.
V PDF verzi si tento dokument můžete stáhnout ZDE
Souhrn
Tato odborná zpráva o použití vakcíny Pfizer COVID-19 (Comirnaty, BNT162b2) u dospívajících je rozdělena do tří částí, které se budou zabývat otázkami v následujícím pořadí:
- Je očkování dospívajících proti COVID-19 nezbytné?
- Je vakcína Pfizer COVID-19 účinná?
- Je vakcína Pfizer COVID-19 bezpečná?
Argumenty uvedené v oddíle 1 se týkají všech vakcín COVID-19, zatímco argumenty uvedené v oddílech 2 a 3 se vztahují konkrétně na vakcínu Pfizer.
Oddíl 1 ukáže, že očkování dospívajících COVID-19 je zbytečné, protože:
- v této věkové skupině je onemocnění téměř vždy mírné a benigní;
- pro vzácné klinické případy, které to vyžadují, je léčba snadno dostupná;
- imunita vůči onemocnění je nyní rozšířená v důsledku předchozí infekce virem (SARSCoV-2) nebo jinými kmeny koronaviru a
- asymptomatičtí adolescenti nepřenášejí onemocnění na jiné osoby, které by mohly být více ohroženy infekcí.
Oddíl 2 prokáže, že tvrzení o účinnosti, které společnost Pfizer přikládá své vakcíně – konkrétně 95% účinnost u dospělých a 100% účinnost u dospívajících – jsou:
- zavádějící, protože tato čísla se týkají relativní, nikoli absolutní účinnosti, která se pohybuje v řádu pouhého 1 %;
- jsou pochybné, protože se vztahují k libovolně definovanému, klinicky bezvýznamnému cílovému bodu hodnocení, zatímco proti závažným onemocněním nebo úmrtnosti nebyla prokázána vůbec žádná účinnost;
- s největší pravděpodobností zcela podvodné.
Oddíl 3 ukáže, že bezpečnostní profil vakcíny Pfizer je katastrofálně špatný. Bude diskutováno, že:
- Společnost Pfizer, EMA a FDA systematicky opomíjely důkazy z předklinických studií na zvířatech, které jasně poukazovaly na vážné nebezpečí nežádoucích účinků;
- vakcína společnosti Pfizer způsobila během pěti měsíců od svého zavedení tisíce úmrtí;
- Agentury, které udělily povolení k mimořádnému použití této vakcíny, se dopustily závažných chyb a opomenutí při posuzování známých a možných zdravotních rizik.
Jediným možným závěrem této analýzy je, že používání této vakcíny u dospívajících nelze povolit, a že by se mělo okamžitě zastavit její používání u všech věkových skupin.
Očkování dospívajících proti COVID-19 je zbytečné.
-
- Co ukazují dostupné důkazy? Existuje několik důkazů, které ukazují, že očkování dospívajících proti COVID-19 není nutné.
- Míra úmrtnosti na COVID-19 v běžné populaci je nízká. Naprostá většina všech osob nakažených COVID-19 se po lehkém, často necharakteristickém onemocnění uzdraví. Podle předního světového epidemiologa Johna Ioannidise [Ioannidis2020, Ioannidis2021a] se fatalita infekce COVID-19 pohybuje v rozmezí 0,15 % až 0,2 % ve všech věkových skupinách s velmi silným příklonem ke starým lidem, zejména těm s komorbiditami. Tato míra nepřesahuje rozmezí běžně pozorované u chřipky, proti níž se očkování dospívajících nepovažuje za naléhavé ani nutné.
- COVID-19 má obzvláště nízkou prevalenci a závažnost u dospívajících. V USA a v dubnu 2020 tvořili mladší 18 let pouze 1,7 % všech případů COVID-19 [CDC-responseteam2020, Tsabouri2021]. V rámci této věkové skupiny bylo nejvíce závažných případů pozorováno u velmi malých dětí [Tsabouri2021]. To je v souladu s tím, že u kojenců chybí zkřížená imunita vůči COVID-19, která je u ostatních věkových skupin dána předchozí expozicí běžným lidským respiračním koronavirům (viz oddíl 1.2.1) U o něco starších dětí byl na počátku roku 2020 pozorován zvláštní multisystémový zánětlivý syndrom [Abrams2020]; je možné, že i tito pacienti ještě neměli zkříženou imunitu.
U osob starších 10 let, ale mladších 18 let, nebyly pozorovány v podstatě žádné závažné případy COVID-19 [Tsabouri2021]. Tato skupina tvořila pouze 1 % hlášených případů, z nichž téměř všechny byly velmi mírné. U dospívajících je tedy riziko poškození infekcí COVID-19 obzvláště nízké. Očkování této věkové skupiny je proto zbytečné.
-
- COVID-19 lze léčit. Řada zkušených lékařů spolupracovala na vytvoření účinných pokynů pro léčbu klinicky manifestního COVID-19 [McCullough2020a]. Možnosti léčby jsou k dispozici jak pro časné stadium onemocnění, u kterého je kladen důraz na inhibici virové replikace, tak pro pozdější stadium, u kterého je prvořadá protizánětlivá léčba. Dva léky, které byly úspěšně použity v časném stadiu, jsou hydroxychlorochin a ivermektin. Oba léky se používaly a stále používají proti řadě dalších onemocnění. Například ivermektin je považován za dostatečně bezpečný, aby se používal nejen k léčbě manifestního svrabu – parazitární infekce kůže, která je nepříjemná, ale není závažná – ale dokonce i preventivně u asymptomatických kontaktů osob nakažených svrabem [Bernigaud2021].
Ivermektin se také hojně používá při léčbě tropických parazitárních onemocnění, jako je onchocerkóza (říční slepota), a proto je na seznamu základních léčiv WHO. Přesto WHO považuje za vhodné varovat v případě přípravku COVID-19 před používáním téhož dobře známého a bezpečného léku mimo klinické studie [Anonymous2021i]. Tuto politiku nelze racionálně zdůvodnit a zcela přiměřeně ji národní či regionální zdravotnické orgány přehlasovaly a jednotliví lékaři po celém světě ji ignorují.
Dostupnost účinné léčby ruší důvody pro nouzové použití vakcín u všech věkových skupin, včetně dospívajících.
-
- Většina lidí, zejména dospívajících, je již vůči SARS-CoV-2 imunní. Vzhledem k mnoha vnitřním chybám a nedostatkům běžně používaných diagnostických metod (viz oddíl 1.2) není možné přesně určit podíl osob, které již byly infikovány virem SARS-CoV2, a těch, které infikovány nebyly. Existují však náznaky, že podíl těch, kteří byli infikováni a uzdravili se, je vysoký:
- Výskyt multisystémového zánětlivého syndromu u dětí (viz oddíl 1.1.2) dosáhl vrcholu na začátku až v polovině roku 2020 a poté s určitým mírným zpožděním ustoupil po počáteční vlně samotného respiračního onemocnění COVID-19 [Flood2021].
- Přibližně 60 % náhodně vybraných testovaných osob z Britské Kolumbie má detekovatelné protilátky proti více proteinům SARS-CoV-2 (osobní sdělení Stephena Pelecha, University of British Columbia), což svědčí o dřívější infekci virem – na rozdíl od očkování, které by vyvolalo protilátky pouze proti jednomu proteinu (spike).
Bylo zjištěno, že prodělaná infekce COVID-19 velmi spolehlivě chrání před opětovnou infekcí [Shrestha2021], a silná specifická humorální a buněčná imunita byla zjištěna téměř u všech vyléčených jedinců a také u těch, kteří zůstali po celou dobu infekce bez příznaků [Nielsen2021]. Velká část jedinců ve všech věkových skupinách, včetně dospívajících, tedy již má specifickou a spolehlivou imunitu vůči COVID-19. Jak bylo uvedeno výše, většina těch, kteří takovou specifickou imunitu nemají, je nicméně chráněna před závažným onemocněním zkříženou imunitou [Grifoni2020, Le_Bert2020]. Tato imunita bude obzvláště účinná u zdravých dospívajících a mladých dospělých. Jedinci se specifickou imunitou nebo dostatečnou zkříženou imunitou nemohou mít z podstoupení experimentálního očkování žádný prospěch.
Asymptomatický přenos COVID-19 není reálný. Často uváděným důvodem pro očkování osob, které samy nejsou ohroženy závažným onemocněním, je potřeba navodit „hromadnou imunitu“: několik málo vysoce ohrožených osob by mělo být chráněno tím, že se zabrání šíření viru v obecné populaci.
Podtextem tohoto zdůvodnění je myšlenka „asymptomatického šíření“ – předpokládá se, že osoby, které byly infikovány, ale nevykazují žádné jiné příznaky než pozitivní PCR test, přenášejí tuto infekci na další vnímavé osoby. Pokud přijmeme myšlenku takového asymptomatického šíření, pak se preventivní hromadné očkování může skutečně jevit jako jediný prostředek spolehlivé ochrany ohrožených osob.
Bylo však jednoznačně zjištěno, že k takovému asymptomatickému přenosu nedochází. V rozsáhlé studii, které se zúčastnilo téměř 10 milionů obyvatel Číny, se nepodařilo vysledovat žádné nové infekce u osob, které byly PCR testem pozitivní na SARSCoV-2, ale nevykazovaly žádné další příznaky infekce [Cao2020]. To se shoduje s několika studiemi, které porovnávaly PCR s izolací viru v buněčné kultuře u pacientů s akutním onemocněním COVID-19. Ve všech případech růst viru v buněčné kultuře ustal s odezněním příznaků nebo velmi krátce poté, zatímco PCR zůstala pozitivní ještě několik týdnů nebo měsíců poté [Wolfel2020, Basile2020]. Proto bylo navrženo používat k posouzení infekčnosti a určení doby trvání izolace spíše buněčnou kulturu než PCR [Basile2020].
Tato zjištění naznačují, že omezení kontaktu rizikových osob s osobami, které vykazují nebo nedávno vykazovaly příznaky akutního respiračního onemocnění, by bylo účinným a dostatečným ochranným opatřením. K dosažení takové ochrany proto není nutné plošné očkování osob, které samy nejsou ohroženy závažným onemocněním.
1.2 Chybějící důkazy: používání nepřesných diagnostických metod. Klíčovým prvkem, který v současné diskusi o potřebě očkování chybí, je spolehlivý diagnostický nástroj pro určení, kdo je či není aktuálně infikován virem SARS-CoV-2. Diagnostický postup, který se k tomuto účelu nejčastěji používá, je založen na polymerázové řetězové reakci (PCR). PCR je velmi výkonná a všestranná metoda, která se hodí k četným aplikacím v molekulární biologii a také v laboratorní diagnostice virových infekcí. Avšak právě proto, že je PCR tak výkonná, je velmi obtížné ji správně provést i v těch nejlepších časech; přesné výsledky poskytne pouze v rukou vysoce vyškoleného a disciplinovaného personálu. Obrovský rozsah, v jakém byla metoda nasazena během pandemie COVID-19, znamenal, že byla svěřena nevyškolenému a nedostatečně kontrolovanému personálu; za takových okolností je hromadná výroba falešně pozitivních výsledků v důsledku křížové kontaminace vzorků katastrofou, která jen čekala na svou příležitost (viz např. [Anonym2021j]). Zatímco již tato skutečnost je sama o sobě důvodem k vážným obavám, problémy začínají ještě dříve – konkrétně s konstrukcí PCR testů a pokyny používanými pro jejich interpretaci, které by vedly k falešně pozitivním výsledkům i v rukou kvalifikovaných a pečlivých pracovníků.
Hlavním závěrem této části bude, že PCR testy, které se používaly během pandemie a které se používají i nadále, nejsou dostatečně přesné a specifické a nelze se na ně spoléhat pro diagnostické nebo epidemiologické účely. Abychom mohli tyto závěry náležitě zdůvodnit, musíme se nejprve podrobně zabývat základy metody.
1.2.1 Koronaviry a SARS-CoV-2. Koronaviry jsou velkou rodinou obalených RNA virů s pozitivním vláknem. U lidí a různých druhů zvířat způsobují infekce dýchacích cest, které mohou mít závažnost od mírné až po smrtelnou. Převážná většina koronavirových infekcí u lidí způsobuje mírné onemocnění (nachlazení), i když u velmi malých dětí, které nemají imunitu z předchozí expozice, může být respirační onemocnění závažnější. Všimněte si, že stejný klinický obraz způsobují také viry z několika dalších čeledí, převážně rhinoviry. Tři klinické syndromy – SARS, MERS a COVID-19 – jsou spojeny se specifickými kmeny koronavirů, které se „objevily“ teprve v posledních 20 letech.
Virus, který způsobuje COVID-19, je známý jako koronavirus 2 těžkého akutního respiračního syndromu (SARS-CoV-2). Světová zdravotnická organizace (WHO) vyhlásila 30. ledna 2020 ohnisko nákazy za mimořádnou událost mezinárodního významu pro veřejné zdraví a 11. března 2020 za pandemii. Ačkoli se tvrdilo, že SARS-CoV-2 vznikl přirozenou cestou u jednoho druhu netopýrů [Andersen2020], důkladná analýza sekvencí genomu SARS-CoV-2 a příbuzných kmenů viru jednoznačně ukazuje, že virus je ve skutečnosti umělého původu [Sorensen2020, Sorensen2020a, Yan2020, Yan2020a]. Toto vysvětlení, které bylo původně deklasováno jako „konspirační teorie“, se v poslední době opožděně dostává do hlavního proudu.
1.2.2 Polymerázová řetězová reakce. Polymerázová řetězová reakce (PCR) je univerzální metoda biochemické replikace deoxyribonukleové kyseliny (DNA) in vitro. Ihned po svém vynálezu Kary Mullisem v 80. letech 20. století vzala PCR svět molekulární biologie útokem a našla uplatnění pro vytváření mutací DNA, sekvenování DNA, pro míchání a slučování nukleových kyselin různého původu (technologie rekombinantní DNA) a pro vytváření nových nukleových kyselin nebo dokonce celých genomů od nuly („syntetická biologie“). PCR si brzy našla cestu také do oblasti diagnostické lékařské mikrobiologie [Yang2004a]. Zejména s ohledem na virové patogeny je nyní PCR jednou z hlavních diagnostických metod. Na tomto pozadí není překvapivé, že metody PCR byly přijaty také v laboratorní diagnostice SARS-CoV-2.
1.2.2.1 Princip. Abychom pochopili, jak PCR funguje, je nejlepší začít s kouskem dvouvláknové DNA (známá dvojitá šroubovice). V takové molekule se každé z párových jednoduchých vláken skládá ze čtyř různých stavebních bloků (nukleotidů), které zde budeme zkráceně označovat jako A, C, G a T. V případě, že se jedná o molekulu DNA, je třeba ji označit jako DNA. V každém jednotlivém vlákně jsou tyto stavební bloky uspořádány jako perly na šňůrce; biologická aktivita a identita nukleové kyseliny bude dána její charakteristickou sekvencí nukleotidů.
Ve dvojité šroubovici DNA drží obě vlákna pohromadě díky správnému párování nukleotidů, takže A v jednom vlákně je vždy naproti T v druhém vlákně, a stejně tak C je vždy naproti G. Nukleotidová sekvence jednoho vlákna tedy implikuje sekvenci druhého vlákna – obě sekvence jsou komplementární.
První krok PCR spočívá v oddělení dvou řetězců, které lze provést zahřátím vzorku DNA nad „bod tání“. Každé vlákno lze nyní použít jako šablonu pro syntézu nové kopie opačného vlákna. Za tímto účelem se přidají dvě krátké syntetické jednořetězcové molekuly DNA („primery“); jejich sekvence se volí tak, aby se na základě komplementarity sekvencí navázala jedna na každé z vláken vzorků DNA. Aby k této vazbě došlo, musí se snížit teplota reakce.
Po navázání primerů se každý z nich prodlouží opakovaným začleněním volných nukleotidových prekurzorů na jeden ze svých dvou volných konců. Toho se dosáhne pomocí termostabilní DNA polymerázy – bakteriálního enzymu, který syntetizuje DNA. Prodlužování probíhá při teplotě, která je střední mezi teplotami používanými pro oddělení dvouřetězce a navázání primeru („ochlazování“). Poté, co se tímto krokem každý z primerů prodlouží do nového vlákna DNA, vytvoříme z jedné dvouřetězcové molekuly DNA dvě. Nyní můžeme proces opakovat – oddělit dvě dvouřetězcová vlákna a přeměnit je na čtyři, pak na osm atd. Po deseti cyklech se původní množství dvouřetězcové DNA zvýší přibližně tisíckrát, po dvaceti cyklech milionkrát a tak dále – amplifikace probíhá exponenciálně s počtem reakčních cyklů, dokud reakce nakonec nevyčerpá primery a/nebo nukleotidové prekurzory.
1.2.2.2 PCR a RNA vzorky. Zatímco výše uvedené pojednání se týkalo pouze DNA, PCR lze použít i s RNA vzorky; to je důležité u SARS-CoV-2, protože tento virus má jako genetický materiál spíše RNA než DNA. Za tímto účelem se RNA nejprve převede („reverzně transkribuje“) na DNA pomocí enzymu reverzní transkriptázy. Kopie DNA virového genomu RNA se označuje jako komplementární DNA (cDNA).
1.2.3 Potenciální úskalí PCR v diagnostických aplikacích. Právě jsme viděli, že PCR nám umožňuje odebrat velmi malý vzorek DNA a amplifikovat jej s mimořádnou účinností. Právě tato účinnost amplifikace však vytváří řadu problémů, které je třeba pečlivě řešit, aby byl výsledek smysluplný, zejména v diagnostickém kontextu.
- Pokud použijeme příliš vysoký počet opakovaných reakčních cyklů, budou detekována nepatrná množství nukleových kyselin, která nemají diagnostický význam.
- Různé teploty použité v reakci musí být pečlivě kalibrovány a musí odpovídat délce a sekvenci nukleotidů obou primerů DNA. Pokud je zejména teplota pro ochlazování primerů příliš nízká, mohou se primery vázat na vzorek DNA nespecificky – navzdory jednomu nebo více neshodným nukleotidům – a může dojít k amplifikaci jiných než zamýšlených molekul DNA. V kontextu diagnostiky COVID by to mohlo znamenat, že se amplifikují například nukleové kyseliny jiných koronavirů než SARS-CoV-2, které jsou s nimi později zaměněny.
- Kromě teploty je třeba pečlivě kalibrovat i další podmínky, aby byla zajištěna specifičnost. Mezi ně patří zejména koncentrace hořečnatých iontů a volných nukleotidů; příliš vysoké koncentrace podporují nespecifickou amplifikaci.
Existuje další problém, který nevyplývá z účinnosti amplifikace, ale spíše z technického omezení: PCR je nejúčinnější, pokud amplifikovaná molekula DNA není delší než několik set nukleotidů; genom koronaviru v plné délce je však dlouhý přibližně 30 000 nukleotidů. Úspěšná amplifikace úseku o délce pouze několika set nukleotidů tedy nedokazuje, že samotný vzorek nukleové kyseliny byl skutečně kompletní a neporušený, a že tedy byl součástí infekční virové částice.
1.2.4 Technická opatření při diagnostické PCR. Před nespecifickou nebo příliš citlivou amplifikací se lze chránit několika způsoby:
- Všechny primery, které jsou součástí stejné reakční směsi, musí být navrženy tak, aby se annealizovaly na templátovou DNA při stejné teplotě. Jak může být intuitivně jasné, delší primer začne ochlazovat na svůj vzorek při vyšší teplotě než kratší primer; a protože vazba, která vzniká mezi C a G na protilehlých vláknech, je těsnější než vazba mezi A a T, musí se brát v úvahu také nukleotidové složení každého primeru. Pokud se primery v tomto ohledu neshodují, pak se ten, který se váže aktivněji, začne vázat nespecificky, když je teplota dostatečně nízká na to, aby se druhý primer mohl vázat specificky. Původní Cormanův-Drostenův protokol PCR [Corman2020], který byl rychle schválen WHO, byl kritizován právě pro tuto chybu [Anonymous2020d].
- Namísto amplifikace pouze jednoho kusu vzorku DNA lze současně amplifikovat několik kusů za použití vhodného počtu párů primerů DNA a stanovit, že všechny kusy nebo vhodný minimální počet musí být úspěšně amplifikovány, aby byl test vyhodnocen jako pozitivní.
- Je třeba sledovat „prahovou hodnotu cyklu“ nebo zkráceně Ct, tj. počet amplifikačních cyklů, které byly nutné k vytvoření detekovatelného množství amplifikovaného produktu; čím nižší je počet cyklů, tím větší musí být počáteční množství vzorku nukleové kyseliny.
- Potvrzení identity – přesné nukleotidové sekvence – amplifikovaných molekul nukleových kyselin. Sekvenování DNA je v rutinních diagnostických laboratořích možné již delší dobu a neexistuje žádný dobrý důvod, proč je nepoužívat, zejména pokud na těchto laboratorních výsledcích závisí rozhodnutí týkající se veřejného zdraví.
1.2.5 PCR v reálném čase. Třetí a do jisté míry i čtvrtý bod lze řešit pomocí PCR v reálném čase. Při této metodě se sleduje hromadění amplifikované DNA v průběhu reakce v reálném čase, přičemž po každém cyklu se kvantifikuje produkt (kvantitativní PCR; zkráceně qPCR). Detekce v reálném čase lze dosáhnout zařazením třetího primeru DNA, který se váže na jedno z vláken vzorku DNA, v místě mezi dvěma dalšími primery, které řídí syntézu DNA. Za vazbou tohoto třetího primeru bude emitován světelný signál, jehož intenzita je úměrná množství přítomné amplifikované DNA. Jelikož vazba tohoto primeru také vyžaduje komplementární cílovou sekvenci na vzorku DNA, poskytuje tato metoda určité potvrzení nukleotidové sekvence cílové DNA.
Druhá, jednodušší varianta PCR v reálném čase používá jednoduchou molekulu organického barviva, která se váže na dvouřetězcovou DNA. Barvivo vykazuje slabou fluorescenci na pozadí, která se po navázání DNA výrazně zvýší. Naměřený nárůst fluorescence je pak úměrný celkovému množství amplifikované DNA; protože se však barvivo váže bez ohledu na sekvenci DNA, signál v tomto případě neposkytuje důkaz, že byla amplifikován správný vzorek DNA.
1.2.6 Nedostatky komerčních PCR testů COVID-19. Počet amplifikačních cyklů (hodnota Ct) potřebných k nalezení daného genetického materiálu je bohužel zřídkakdy uvedena ve výsledcích zasílaných úřadům, lékařům a testovaným osobám. Většina komerčně dostupných RT-qPCR testů stanovuje hranici amplifikačních cyklů, do které by měl být amplifikační signál považován za pozitivní, na 35 nebo více. Z mnoha studií vyplývá, že hodnoty Ct nad 30 mají velmi nízkou prediktivní hodnotu pro pozitivní kultivaci viru, a tedy pro infekčnost nebo přítomnost akutního onemocnění [Jaafar2020, Liotti2020, Wolfel2020, Bullard2020]. Vzhledem k tomu, že v mnoha klinických studiích – včetně studií prováděných společností Pfizer (viz dále) – se „případ COVID-19“ neboli „koncový bod“ rovná pouze pozitivnímu testu PCR bez ohledu na hodnotu Ct v kombinaci s jedním nebo několika nespecifickými příznaky respiračního onemocnění, nelze význam použití nesprávně vysokých hraničních hodnot Ct přeceňovat. Již tato systematická a rozšířená chyba stačila k závažnému zkreslení diagnóz stanovených jednotlivým pacientům i epidemiologie pandemie jako celku.
Další systematická nedbalost se týká ověření identity amplifikovaných fragmentů DNA. Ačkoli je Sangerovo sekvenování DNA takových fragmentů, které je zlatým standardem, v zásadě proveditelné ve velkém měřítku, v probíhajících kampaních hromadného testování PCR se rutinně nepoužívá. K chybě přispívá velmi nízký počet nezávislých amplifikací PCR, které jsou považovány za dostatečné pro pozitivní test – v různých jurisdikcích byly za dostatečné považovány pouze dvě, nebo dokonce pouze jedna – a také různé další technické chyby v široce přijatém a komerčně využívaném Cormanově-Drostenově protokolu, které byly podrobně popsány jinde [Anonymous2020d].
Lze shrnout, že pozitivní výsledek testu RT-qPCR nelze považovat za důkaz, že dotyčná osoba je v současné době nakažená a infekční – a to ani v případě, že existuje přiměřená klinická pravděpodobnost skutečné infekce COVID-19 a značný výskyt onemocnění v komunitě. Za prvé, materiál RNA obsahující cílové sekvence může velmi dobře pocházet z neživého/neaktivního viru; to je obzvláště pravděpodobné, pokud se dotyčný pacient již z infekce zotavil. Za druhé, pro další přenos je třeba minimální množství životaschopného viru; ale testy prováděné s příliš vysokými (dosud neohlášenými) hodnotami Ct odhalí nepatrná množství genetického materiálu, která nepředstavují žádné skutečné riziko.
2. Vakcína COVID-19 společnosti Pfizer není dostatečně účiná
Co ukazují důkazy? Společnost Pfizer se vytrvale ohání 95% účinností své vakcíny na základě klinických studií, které byly základem pro mimořádné schválení FDA [Anonymous2020] a Evropské unie [Anonymous2021f]. V novější studii na dospívajících
[Frenck2021] byla deklarovaná účinnost zvýšena na ne méně jak 100 %. Tato tvrzení však nelze brát za bernou minci.
2.1.1 Absolutní vs. relativní účinnost. V první oznámené klinické studii společnosti Pfizer/BioNTech bylo randomizováno 43 548 účastníků, z nichž 43 448 dostalo injekce. Experimentální vakcína (BNT162b2) byla podána 21 720 osobám a 21 728 osob dostalo placebo. V obou skupinách bylo zaznamenáno celkem 170 „případů“ COVID-19, z nichž 162 se vyskytlo ve skupině s placebem, zatímco ve skupině s vakcínou BNT162b2 bylo pozorováno 8 případů. Na základě těchto číselných údajů – 8/162≈5 % – přistoupila společnost Pfizer k tvrzení o 95% účinnosti. Je však zřejmé, že tato účinnost je pouze relativní hodnotou – v absolutním vyjádření se COVID-19 vyskytl u méně než 1 % placebové skupiny, a proto před ním bylo chráněno méně než 1 % očkované skupiny.
Podobná situace je i u následného menšího testu provedeného na 12-15letých adolescentech [Frenck2021]. Zde skupina s vakcínou zahrnovala 1131 osob, zatímco skupina s placebem 1129 osob. V posledně jmenované skupině bylo následně diagnostikováno 16 jedinců s COVID-19, zatímco ve skupině s vakcínou se žádný takový případ nevyskytl. Společnost Pfizer/BioNTech tuto absolutní účinnost 1,4 % převedla na relativní účinnost 100 %; v abstraktu publikované studie je zdůrazněna pouze druhá hodnota.
2.1.2 Negativní vliv BNT162b2 na celkovou nemocnost u dospívajících. V citované studii vakcíny u dospívajících byl „případ“ COVID-19 stanoven následovně:
Definice potvrzeného COVID-19 zahrnovala přítomnost ≥ 1 příznaku (tj. horečka, nový nebo zesílený kašel, nová nebo zesílená dušnost, zimnice, nová nebo zesílená bolest svalů, nová ztráta chuti nebo čichu, bolest v krku, průjem, zvracení) a pozitivitu SARS-CoV-2 NAAT [=PCR-pozitivní] během období symptomů nebo během 4 dnů před nebo po něm (buď v centrální laboratoři, nebo v místním testovacím zařízení a za použití přijatelného testu).
K určení diagnózy byl tedy považován za dostačující jediný příznak z nepřeberného seznamu necharakteristických příznaků a pozitivní nález z nespolehlivého laboratorního testu (viz oddíl 1.2.6). Studie sice dále uvádí několik klinických kritérií závažného onemocnění, ale neuvádí, že by některá z nich u testovaných osob skutečně nastala. Lze tedy předpokládat, že v celé testované populaci se vyskytlo jen velmi málo nezávažných a žádný klinicky závažný případ onemocnění COVID-19.
V ostrém kontrastu s těmito čísly týkajícími se nemoci, před kterou má očkování chránit, byly vedlejší účinky očkování mimořádně časté. Kromě bolesti v místě vpichu, která se vyskytovala u vysokého procenta očkované skupiny (79 % až 86 %), se hojně vyskytovala únava (60 % až 66 %) a bolest hlavy (55 % až 65 %). Silnou únavu a bolest hlavy hlásilo několik procent testovaných osob. Zejména silné bolesti hlavy mohou souviset se základními trombotickými příhodami (viz bod 3.1.3.2).
A
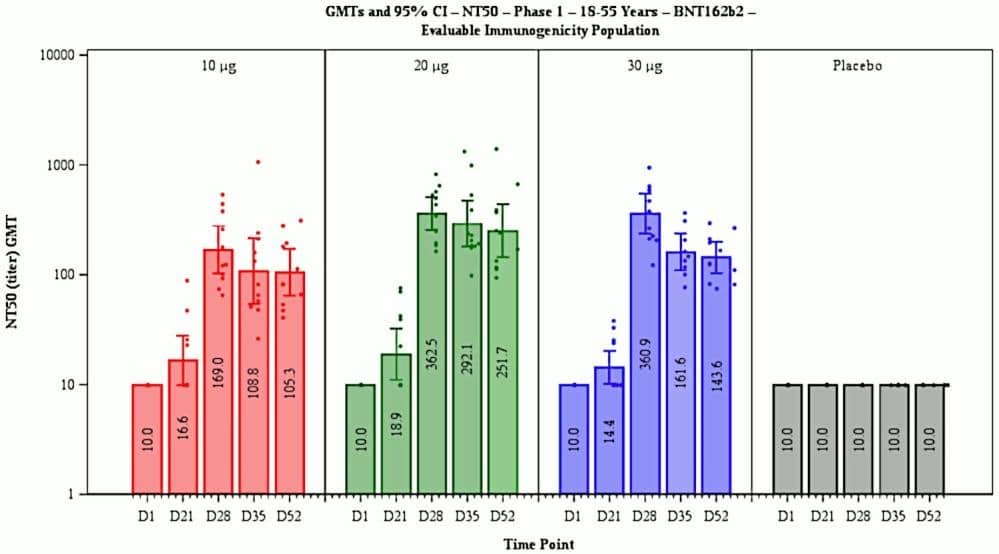
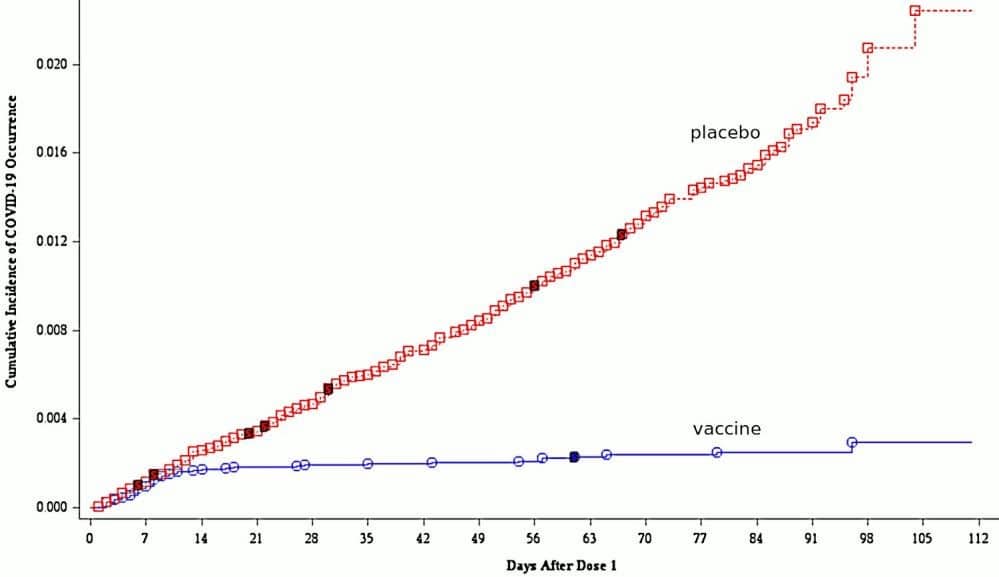
Obrázek 1 Reprodukce obrázku 7 (A; titry neutralizačních protilátek v různých dnech po první injekci) a obrázku 9 (B; kumulativní výskyt COVID-19 ve skupinách očkovaných a placebo) z hodnotící zprávy EMA [Anonymous2021f]. Všimněte si logaritmické osy y v bodě B. Diskuse viz text.
Je tedy zřejmé, že pokud vezmeme v úvahu jak nežádoucí účinky COVID-19, tak nežádoucí účinky vakcíny, byla celková nemocnost mnohem vyšší ve skupině očkovaných než ve skupině s placebem.
2.1.3 Nepravděpodobná tvrzení a rozpory v důkazech společnosti Pfizer o účinnosti. Výše jsme viděli, že uváděná účinnost vakcíny společnosti Pfizer je velmi skromná, je-li vyjádřena v absolutních hodnotách. Ani tuto nízkou účinnost však nelze přijmout za bernou minci. Vyplývá to z hodnotících zpráv vypracovaných FDA [Anonymous2020] a EMA [Anonymous2021f].
2.1.3.1 Náhlý nástup imunity 12. den po první injekci. Klíčová ilustrace, která se vyskytuje v obou zprávách, porovnává kumulativní výskyt COVID-19 u očkované a placebové skupiny. Tento graf, který je ve zprávě EMA uveden jako obrázek 9, je zde reprodukován na obrázku 1B. Až do 12. dne po první injekci se kumulativní incidence v obou skupinách navzájem těsně sledují. Po 12. dni však pouze ve skupině s placebem pokračuje stabilní kumulace dalších nových případů, zatímco ve skupině s vakcínou klesá sklon grafu téměř k nule.
Toto pozoruhodné pozorování naznačuje, že imunita nastupuje velmi náhle a rovnoměrně 12. den právě u očkovaných. Vzhledem k tomu, že druhá injekce byla aplikována 19 nebo více dní po první injekci, znamenalo by to, že k vytvoření plné imunity stačí jedna injekce. Tento závěr však není uveden a společnost Pfizer ve skutečnosti neuvádí vůbec žádné údaje o testovaných osobách, které dostaly pouze jednu injekci.
Náhlý nástup plné imunity 12. den po první expozici antigenu není vůbec biologicky pravděpodobný. Obvykle se imunita vyvíjí pomaleji, a postupně, a takový vzorec je ve skutečnosti uveden u téže vakcíny (BNT162b2) na obrázku 7 zprávy EMA, který je zde reprodukován jako obrázek 1A. Obrázek ukazuje nárůst neutralizačních protilátek proti SARS-CoV-2 v závislosti na čase po první injekci vakcíny.
Indukce neutralizačních protilátek je deklarovaným účelem vakcíny společnosti Pfizer. Obecně řečeno, protilátky jsou bílkovinné molekuly, které produkuje náš imunitní systém při setkání s antigeny – makromolekulami, které se v našem těle nevyskytují. Tyto antigeny jsou často součástí infekčních mikrobů, včetně virů. Protilátka se váže na specifický znak na povrchu antigenu; tento znak se nazývá epitop dané protilátky.
V souvislosti s virovými infekcemi mohou být protilátky neutralizační nebo ne-neutralizační. Neutralizační protilátka rozpoznává epitop, který je nezbytný pro funkci viru, například proto, že tento epitop musí navázat kontakt s receptorovou molekulou na povrchu hostitelské buňky, do které musí virus vstoupit, aby se mohl replikovat. Ne-neutralizující protilátka jednoduše rozpoznává povrchový prvek (epitop), který nehraje v infekčnosti viru žádnou podstatnou roli.
Vzhledem k výše uvedenému bychom měli očekávat, že hladina neutralizačních protilátek v krvi by měla odrážet stupeň klinické imunity vůči viru. To však vůbec není to, co vidíme na obrázku 1A. V 21. den po první injekci, tj. celých 9 dní po údajném náhlém nástupu plné klinické imunity, množství neutralizačních protilátek v krvi sotva stouplo nad úroveň pozadí. Maximální hladina neutralizačních protilátek je pozorována až 28. den po první injekci, kdy by většina testovaných osob již měla za sebou druhou injekci. Časový průběh buněčné (T-buněčné) imunity nebyl uveden, ale vzhledem k absenci důkazu o opaku lze předpokládat, že se podobá protilátkové odpovědi.
Je velmi obtížné sladit dvě protichůdná pozorování, kdy se 12. den náhle objeví plná klinická imunita, ale neutralizační protilátky se objeví až o několik týdnů později. Přesto se zdá, že ani hodnotitelé EMA, ani hodnotitelé FDA se o tento problém nezajímali.
2.1.3.2 Dokumentace společnosti Pfizer si v otázce výskytu COVID-19 po očkování protiřečí. Tabulka 1 uvádí procenta subjektů ve skupině s vakcínou a ve skupině s placebem, u nichž nebyly zjištěny žádné známky infekce SARS-CoV-2 v den 0 (před první dávkou), resp. v den 14 po druhé dávce. Z rozdílů mezi oběma časovými body lze odvodit, že 7,5 % subjektů v očkovací skupině a 8 % v kontrolní skupině se mezi oběma časovými body změnilo z negativních na pozitivní, tj. nakazilo se.
Podle [Anonymous2020] byla druhá dávka podána přibližně 21 dní po první, ačkoli do hodnocení byly zahrnuty všechny subjekty, které ji dostaly mezi 19. a 42. dnem po první injekci. Pokud vezmeme den 35 po první injekci jako přibližného časového bodu srovnání,
Tabulka 1 Osoby bez známek infekce ve skupinách očkovaných a s placebem v různých časových bodech klinického hodnocení. Údaje převzaty z Tabulky 4 v [Anonymous2021f]. Diskuse viz text.
| Vakcína | Placebo | |
| Žádné známky infekce před dávkou 1 | 93.1% | 93.0% |
| Žádné známky infekce před 14 dní po dávce 2 | 85.6% | 85.0% |
| Rozdíl (=infekce mezi dnem 0 a dnem 14 po dávce 2) | 7.5% | 8.0% |
Tabulka 2 Výskyt COVID-19 u osob, které nebyly dříve infikovány, ale byly očkovány, nebo u osob, které byly dříve infikovány, ale nebyly očkovány. Údaje převzaty z Tabulek 6 a 7 v [Anonymous2020]. Diskuse viz text.
vidíme z obrázku 1B, že kumulativní incidence mezi dnem 0 a 35 je více než dvakrát vyšší ve skupině s placebem než ve skupině s vakcínou; z tabulky 1 však vidíme, že je téměř stejná. Navíc u obou skupin jsou čísla v tabulce podstatně vyšší než na obrázku.
Tyto dva soubory údajů nelze uvést v soulad; jeden z nich musí být nepravdivý. Vzhledem k tomu, že náhlý nástup imunity, jak je uvedeno na obrázku 1B, postrádá jakoukoli biologickou věrohodnost, je velmi pravděpodobné, že právě tento soubor dat byl vymyšlen.
2.1.3.3 Z údajů společnosti Pfizer vyplývá, že vakcína chrání před COVID účinněji než předchozí infekce virem. Údaje uváděné společností Pfizer můžeme také podrobně prozkoumat, abychom porovnali imunitu, kterou poskytuje vakcína, s imunitou vyvolanou předchozí přirozenou infekcí virem. Příslušné údaje jsou shrnuty v tabulce 2. Hlášených 8 případů COVID-19 u očkovaných osob, které byly původně testovány na virus negativně, představují incidenci 0,044 %. Společnost Pfizer rovněž uvádí 7 případů u osob, které byly původně pozitivně testovány, ale nebyly očkovány. Vzhledem k tomu, že tato skupina je podstatně menší, znamená těchto 7 případů téměř devítinásobně vyšší incidenci (0,38 %).
Je všeobecně známo, že vakcíny se v nejlepším případě přiblíží imunitě, kterou poskytuje příslušná přirozená infekce, ale nepřekonají ji. Nedávno byla zaznamenána velmi silná imunita po předchozí přirozené infekci virem SARS-CoV-2 [Shrestha2021]; v této studii nebyl mezi 1359 jedinci, kteří zůstali neočkováni, pozorován ani jeden případ COVID-19. Robustní imunitu po infekci potvrzují také komplexní laboratorní vyšetření [Nielsen2021]. Výše uvedená analýza tedy opět potvrzuje, že výsledkům studie uváděným společností Pfizer nelze věřit. Skutečnost, že ani FDA, ani EMA nezaznamenaly žádný z těchto rozporů, nevzbuzuje důvěru v důkladnost a poctivost jejich přezkumných procesů.
2.2 Jaké důkazy chybí k prokázání této skutečnosti? Již jsme se zmínili o zvláštním a vykonstruovaném charakteru koncového bodu použitého v klinických studiích společnosti Pfizer – konkrétně o započítání „případu“ COVID-19 na základě pouhého pozitivního výsledku PCR spolu s jednou nebo více položkami ze seznamu většinou necharakteristických klinických příznaků. Musíme se proto ptát, zda vakcína poskytuje nějaké výhody, které jsou podstatnější než deklarované – ale jak bylo uvedeno výše, s největší pravděpodobností vymyšlené – snížení počtu takových triviálních „případů“.
2.2.1 Prevence závažných onemocnění a úmrtnosti. Na straně 48 zprávy FDA je tato otázka shrnuta takto: „K potvrzení účinnosti vakcíny proti úmrtnosti by bylo zapotřebí většího počtu jedinců s vysokým rizikem onemocnění COVID-19 a vyššího počtu infekčních napadení.“
Podotýkáme, že tato citace nejenže odpovídá na položenou otázku záporně, ale také vyvrací celou záminku pro udělení povolení k mimořádnému použití této experimentální vakcíny. Pokud je ve studii, která zahrnuje 40 000 jedinců, počet smrtelných následků příliš malý na to, aby bylo možné zjistit jakýkoli přínos vakcíny, pak jistě neexistuje žádná „mimořádná situace“, která by ospravedlňovala velmi vážná rizika a mezitím zjevné škody spojené s mimořádně uspěchaným zavedením této a dalších vakcín COVID-19.
V citované studii na dospívajících [Frenck2021] nedošlo k žádnému úmrtí a již jsme uvedli, že ani tato studie neuvádí žádné případy závažného onemocnění. Ani v této specifické věkové skupině tedy není prokázán významný přínos, ani mimořádnost situace.
2.2.2 Účinnost pro osoby s vysokým rizikem závažného onemocnění COVID-19. Zpráva FDA zde uvádí následující: „Ačkoli podíl účastníků s vysokým rizikem závažného COVID19 je pro celkové hodnocení bezpečnosti v dostupném období sledování dostatečný, podskupina určitých skupin, jako jsou imunokompromitovaní jedinci (např. osoby s HIV/AIDS), je příliš malá pro hodnocení výsledků účinnosti„.
Zpráva se vyhýbá otázce snížení rizika u osob s častějšími predispozičními stavy, jako je například chronické onemocnění srdce nebo plic. Klinická studie na dospívajících [Frenck2021] je v tomto ohledu samozřejmě zcela neplodná. Celkově klinické studie společnosti Pfizer nepřinesly žádné důkazy, které by prokazovaly klinický přínos u osob s vysokým rizikem závažného onemocnění COVID-19.
2.2.3 Účinnost proti dlouhodobým účinkům onemocnění COVID-19. Verdikt zprávy FDA je následující: „K posouzení účinku vakcíny na prevenci dlouhodobých účinků onemocnění COVID-19 budou zapotřebí další hodnocení, včetně údajů z klinických studií a z používání vakcíny po jejím povolení.“ Jinými slovy, klinické studie žádné takové důkazy neposkytly.
2.2.4 Snížení přenosu. K tomuto tématu zpráva FDA pouze uvádí, že „k posouzení účinku vakcíny na prevenci vylučování viru a přenosu, zejména u osob s asymptomatickou infekcí, budou zapotřebí další hodnocení včetně údajů z klinických studií a z používání vakcíny po jejím schválení“.
Jednoduše řečeno, neexistuje žádný důkaz o tom, že by se přenos snížil, a ve skutečnosti zkoušky nebyly ani navrženy tak, aby takový účinek prokázaly nebo vyvrátily.
2.2.5 Doba trvání ochrany. Zpráva FDA správně uvádí (na straně 46), že „vzhledem k tomu, že průběžné a závěrečné analýzy mají omezenou délku sledování, není možné posoudit trvalou účinnost po dobu delší než 2 měsíce„. I kdybychom se rozhodli věřit, že vůbec nějaká účinnost byla prokázána, pokud jde o dvouměsíční období studie, tak krátké trvání ochrany neospravedlňuje rizika spojená s očkováním.
2.2.6 Nedostatečné úsilí o stanovení optimální dávky. Obrázek 1A ukazuje, že hladina neutralizačních protilátek je prakticky stejná při dávkách vakcíny (mRNA) 20 µg a 30 µg. To vyvolává otázku, proč byla po celou dobu používána vyšší dávka – a to nejen u dospělých, na kterých byly tyto údaje získány, ale také u dětí, jejichž nižší tělesná hmotnost by měla naznačovat snížení dávky. Údaje na obrázku 1B navíc naznačují, že plná imunita je navozena již první dávkou; aplikace druhé dávky nemění rychlost, jakou přibývají nové případy ve skupině očkovaných, a zřejmě tedy nemá na imunitu žádný vliv. To by znamenalo, že mělo být vyhodnoceno schéma s jednou dávkou, které by snížilo celkovou pravděpodobnost výskytu nežádoucích účinků.
2.2.7 Shrnutí. Klinické studie provedené společností Pfizer neobsahují žádný důkaz o přínosu vakcíny s ohledem na jakékoli klinicky relevantní koncové body. To platí pro všechny testované věkové skupiny a zejména také pro dospívající.
Vakcína COVID-19 společnosti Pfizer postrádá bezpečnost
-
- Co ukazují důkazy? Klinické studie vakcíny Comirnaty (BNT162b2), stejně jako ostatních vakcín COVID-19, byly provedeny ve velmi krátkém čase, což znamenalo, že nebyla přijata náležitá opatření k zajištění jejich bezpečnosti. Pokusy na zvířatech provedené před zahájením klinického testování však již dávaly důvod očekávat závažnou toxicitu. Toto očekávání se bohužel od začátku masového očkování v praxi hojně potvrdilo.
3.1.1 Předklinické údaje z pokusů na zvířatech naznačují možnost vážného poškození.
Comirnaty, stejně jako všechny ostatní vakcíny založené na genetické modifikaci COVID19, způsobuje in vivo expresi jednoho specifického proteinu SARS-CoV-2, a to tzv. spike proteinu, který se nachází na povrchu virové částice. Protein spike zprostředkovává počáteční přichycení virové částice k hostitelské buňce a také její následný vstup do buňky.
Klíčová myšlenka vakcíny Comirnaty je následující:
- syntetická mRNA, která kóduje spike protein, je komplexována se směsí neutrálních a kationtových (kladně nabitých) syntetických lipidů, které se shlukují do lipidových nanočástic (LNP);
- po injekci LNP usnadňují vstřebávání mRNA do hostitelských buněk, kde mRNA způsobí expresi (syntézu) spike proteinu;
- spike protein se objeví na povrchu hostitelských buněk a vyvolá proti sobě imunitní reakci.
Imunitní reakce na spike protein bude zahrnovat jak protilátky, které mohou, ale nemusí být neutralizační (viz oddíl 2.1.3.1), tak T-lymfocyty (T-buňky). Některé z těchto T-lymfocytů jsou cytotoxické (známé také jako T-lymfocyty); jejich funkcí je zabíjet virem infikované tělní buňky.
Ačkoli tato strategie očkování může na papíře vypadat dobře, má řadu nevýhod a rizik.
Tyto vyplývají jak ze směsi lipidů, tak ze spike proteinu, pro své známé toxické účinky.
3.1.1.1 Toxické a prokoagulační aktivity spike proteinu. Závažné klinické onemocnění COVID19 je často doprovázeno patologickou aktivací srážení krve [Campbell2021].
Ústřední role spike proteinu při této komplikaci je známa [Frydman2020]. Pozoruhodné je, že existují nejméně dva různé mechanismy spouštění krevní koagulace:
- Pokud je spike protein exprimován v cévních endoteliálních buňkách – nejvnitřnější buněčné vrstvě cév – může imunitní reakce na spike protein tyto buňky zničit. Výsledná cévní léze aktivuje srážení krve. Tato imunitní reakce může zahrnovat cytotoxické Tbuňky, ale také protilátky, které spouštějí komplementový systém a další imunitní efektorové mechanismy.
- Molekuly spike proteinů, které se tvoří v krevním oběhu nebo se do něj dostávají po syntéze v jiných částech těla, se mohou přímo vázat na krevní destičky (trombocyty) a aktivovat je. Tím se opět spustí srážení krve.
Druhý mechanismus je významný tím, že nezahrnuje imunitní reakci, a proto může být spuštěn ihned i u osob, které nemají žádnou předchozí imunitu. První mechanismus bude nejúčinnější u osob, které již mají imunitu vůči spike proteinu, a to buď v důsledku infekce virem, nebo předchozí injekce vakcíny. Všimněte si, že základní mechanismus poškození buněk bude fungovat i v jiných tkáních – každá buňka v těle, která exprimuje spike protein, se tak stane cílem imunitního systému.
Vzhledem k tomu, že vakcíny Comirnaty a další vakcíny na bázi genetické modifikace vyvolávají syntézu aktivního, a tedy potenciálně toxického proteinu spike, je důležité pochopit, jak se tento protein v těle distribuuje. Toxicita by mohla být omezena, pokud by vakcína, a tedy syntéza spike proteinu, zůstala omezena pouze na místo injekce, ve svalové tkáni, ale mimo krevní oběh. Na druhou stranu, pokud by se vakcína dostala do krevního oběhu, bylo by třeba očekávat expresi spike proteinu v cévách a toxicitu prostřednictvím aktivace srážení krve.
3.1.1.2 Distribuce vakcíny v pokusech na zvířatech. Jak se ukázalo, vakcína se po intramuskulární injekci skutečně velmi rychle objeví v krevním oběhu. V pokusech, které společnost Pfizer oznámila japonským zdravotnickým orgánům [Anonym2020g], byl potkanům aplikován vzorek makety vakcíny. Tento materiál byl chemicky podobný Comirnaty, ale obsahoval molekulu mRNA, která kódovala snadno sledovatelný, netoxický modelový protein (luciferázu), a nikoliv samotný spike protein hrotu SARS-CoV2. Směs lipidů použitá k vytvoření LNP byla úplně stejná jako u Comirnaty. Jeden z lipidů v této směsi byl radioaktivně značen, což umožnilo citlivě a přesně sledovat a kvantifikovat distribuci vzorku v těle. Bylo učiněno několik pozoruhodných pozorování:
- Radioaktivní lipid se rychle objevil v krevním řečišti. Koncentrace v krevní plazmě dosáhla maxima po 2 hodinách, ale již po 15 minutách experimentu dosáhla 45 % této maximální hodnoty.
- Velmi vysoké hladiny radioaktivních lipidů se hromadily v játrech, slezině, nadledvinách a vaječnících.
- V centrálním nervovém systému (mozek a mícha) se hromadí poměrně nízké hladiny.
- Exprese modelového proteinu kódovaného mRNA byla studována pouze v játrech, kde byla snadno detekována.
3.1.1.3 Mechanismus vstřebávání vakcíny do krevního oběhu. Vzhledem k tomu, že komplex tvořený mRNA s navázanými LNP má poměrně velkou molekulovou velikost, musíme se ptát, jak se mu podařilo tak rychle vstoupit do krevního oběhu. Po intramuskulární injekci by měla většina vakcíny skončit v „intersticiálním“ prostoru, tj. v extracelulárním prostoru mimo cévy. Tento prostor je od intravaskulárního prostoru (krevního oběhu) oddělen kapilární bariérou, která umožňuje volný průchod pouze malým molekulám, jako je kyslík nebo glukóza (krevní cukr), ale je nepropustná pro velké molekuly, jako jsou plazmatické bílkoviny; a částice vakcíny by byly ještě větší než tyto.
Tekutina v mezibuněčném prostoru je průběžně odváděna lymfatickým systémem; veškerá lymfatická tekutina se nakonec dostává do krevního oběhu hrudním řečištěm. Částice, které jsou příliš velké na to, aby překonaly kapilární bariéru, se nakonec mohou dostat do krevního oběhu prostřednictvím této lymfatické drenáže. Tento proces však bývá podstatně pomalejší [Kourtis2013], než bylo pozorováno zde u modelové vakcíny. Musíme si proto položit otázku, zda modelová vakcína mohla prolomit kapilární bariéru a získat tak přímý vstup do krevního oběhu.
Směsi lipidů podobné těm, které jsou obsaženy ve vakcíně společnosti Pfizer, byly experimentálně použity k průniku přes hematoencefalickou bariéru po intravenózní injekci [Ye2019]. Krevní mozkovou bariéru lze popsat jako „obohacenou verzi“ běžné kapilární bariéry – pokud ji lze prolomit, musíme totéž očekávat i u běžné kapilární bariéry. Vysoká lokální koncentrace lipidových nanočástic, která vznikne po intramuskulární injekci, bude dále podporovat prolomení bariéry. Výsledkem toho je, že se vakcína objeví v krevním řečišti ve velkém množství a v krátkém čase. Je proto třeba počítat s komplikacemi způsobenými srážlivostí krve.
3.1.1.4 Další známky toxicity LNP. Předpokládané narušení kapilární bariéry LNP znamená cytotoxický účinek na endotelové buňky, které tvoří jedinou buněčnou součást kapilárních stěn. Cytotoxické účinky LNP jsou patrné také z poškození svalových vláken v místě vpichu [Anonymous2021f] a jaterních buněk [Anonymous2021f]. Všimněte si, že i tyto údaje byly získány s modelovou mRNA kódující pravděpodobně netoxický enzym luciferázu. Tyto cytotoxické účinky tedy nejsou způsobeny přímým působením spike proteinu. Imunologickou složku poškození buňky nelze zcela vyloučit, ale v tomto případě pravděpodobně není dominantní, protože luciferáza se na rozdíl od spike proteinu nepřenáší na povrch buňky.
3.1.1.5 Mechanismy akumulace ve specifických orgánech. Vysoká míra akumulace vakcíny v játrech a slezině naznačuje vychytávání makrofágovými buňkami, které jsou v obou orgánech hojně zastoupeny a obecně mají na starosti odstraňování nežádoucích zbytků. Akumulace v nadledvinkách, vaječnících a opět v játrech naznačuje roli lipoproteinů při buněčném vychytávání v těchto orgánech. Lipoproteiny jsou komplexy lipidů a specifických bílkovinných molekul (apolipoproteinů), které fungují jako nosiče lipidů v krevním řečišti. Játra mají ústřední úlohu v metabolismu lipidů a lipoproteinů obecně, zatímco nadledviny a vaječníky přijímají lipoproteiny, aby získaly cholesterol, který pak přeměňují na příslušné steroidní hormony. Taková role lipoproteinů při transportu a buněčném příjmu lipidových nanočástic je v podstatě akceptována [Dal_Magro2017]. Musíme proto očekávat, že podobně budou postiženy i další orgány s vysokou mírou vychytávání lipoproteinů. Patří sem zejména placenta, která stejně jako vaječníky produkuje velké množství steroidního hormonu (progesteronu), a mléčné žlázy v období laktace, které získávají cholesterol obsažený v lipoproteinech pro vylučování do mateřského mléka.
3.1.1.6 Korelace příjmu lipidů a exprese mRNA. V předmětné experimentální studii bylo rovněž prokázáno, že játra exprimují mRNA, která je spojena s LNP (viz
[Anonymous2021f], oddíl 2.3.2). Jak bylo uvedeno výše, mRNA použitá v této studii kódovala enzym světlušky luciferázu, což je právě ten protein, který těmto živočichům umožňuje svítit ve tmě. Savčí tkáně exprimující tento enzym budou také světélkovat, a to úměrně množství proteinu luciferázy, který syntetizují. Měření této luminiscence však není příliš citlivé, což byl pravděpodobně důvod, proč je společnost Pfizer prováděla pouze s játry, ale ne s jinými, menšími orgány. Vzhledem k tomu, že však neexistuje důkaz o opaku, musíme předpokládat, že korelace mezi účinným vychytáváním LNP a expresí mRNA, která platí pro játra, bude platit i u jiných orgánů. Pokud náklad mRNA kóduje spike protein, pak budou tyto orgány vystaveny toxicitě spike proteinu a imunitní reakci proti němu úměrně úrovni LNP a vychytávání mRNA.
3.1.1.7 Potenciální rizika pro plodnost a kojeného novorozence. Vysoká úroveň exprese spike proteinu ve vaječnících zvyšuje vyhlídku na významné poškození tohoto orgánu s možnými důsledky pro plodnost žen. Přijetí vakcíny buňkami mléčné žlázy otevírá dvě možné cesty toxicity pro kojené dítě: zaprvé expresi spike proteinu a jeho vylučování do mateřského mléka a zadruhé plošný přenos vakcíny do mléka. Mléčné žlázy jsou apokrinní, což znamená, že odštěpují a uvolňují do mléka fragmenty vlastní cytoplazmy; cokoli, co se dostalo do cytoplazmy, se tedy může dostat i do mateřského mléka. V této souvislosti upozorňujeme, že jak databáze VAERS, tak registr nežádoucích účinků léčiv v EU (EudraVigilance) hlásí smrtelné případy u kojených novorozenců po očkování jejich matek (viz oddíl 3.1.3.6).
3.1.1.8 Nevyšetření rizik z předklinických studií společností Pfizer. S výjimkou plodnosti, kterou jednoduše nelze vyhodnotit během krátké doby, po kterou se vakcíny používají, byla všechna výše uvedená rizika od zavedení vakcín do oběhu doložena – všechna se projevují v hlášeních do různých registrů nežádoucích účinků (viz bod 3.1.3). Musíme znovu zdůraznit, že každé z těchto rizik bylo možné snadno odvodit z citovaných omezených předklinických údajů, ale nebyla sledována odpovídajícími hloubkovými šetřeními. V klinických studiích nebyly zejména sledovány žádné laboratorní parametry, které by mohly poskytnout informace o těchto rizicích, jako jsou parametry týkající se krevní srážlivosti (např. D-dimery/trombocyty) nebo poškození jater (např. γ-glutamyltransferáza).
3.1.2 Kontaminace vznikající při výrobním procesu. Při výrobním procesu BNT162b2 v komerčním měřítku vzniká několik kontaminací, které mohou ohrozit bezpečnost a účinnost vakcíny. Pro stručnost zde uvedeme pouze dvě takové kontaminace.
3.1.2.1 Kontaminující bakteriální DNA. MRNA se vyrábí in vitro pomocí vzorku DNA, který se zase získává z bakteriálních buněk. Ačkoli jsou přijata opatření k následnému odstranění této DNA, nejsou zcela účinná, což je přiznáno ve zprávě EMA (strany 17 a 40). Kontaminující DNA vstříknutá s vakcínou se může vložit do genomu hostitelských buněk a způsobit potenciálně škodlivé mutace. Bakteriální DNA také nespecificky podporuje zánět.
3.1.2.2 Lipidové nečistoty. Zpráva EMA rovněž uvádí nečistoty pocházející ze syntézy lipidových složek vakcíny (strana 24):
V některých nedávno vyrobených šaržích hotových výrobků byly pozorovány nečistoty související s lipidy, které souvisely se šaržemi ALC-0315 s lipidy. Kvalita pomocné látky ALC-0315 je na základě dostupných údajů považována za přijatelnou pod podmínkou, že specifické nečistoty v konečném přípravku budou dále hodnoceny.
Vzhledem k tomu, že syntetický lipid označovaný jako ALC-0315 nebyl nikdy předtím použit u lidí, neexistuje žádný spolehlivý empirický základ pro rozhodnutí o „přijatelných“ hladinách nečistot. Navíc se zdá, že kontaminující druhy nebyly ani identifikovány. Svévolné plošné schválení neznámých kontaminantů neprokázané složky vakcíny ze strany EMA je zcela nepřijatelné.
3.1.3 Nežádoucí příhody po zahájení očkování. Od zavedení vakcín bylo do registrů po celém světě hlášeno mnoho nežádoucích příhod. Zde se zaměříme na dva registry, a to na americký systém hlášení nežádoucích účinků vakcín (VAERS) a na systém EU pro monitorování nežádoucích účinků léčiv (EudraVigilance). Všechna níže uvedená čísla jsou k 21. květnu, pokud není uvedeno jinak.
3.1.3.1 Úmrtí hlášená v souvislosti s vakcínami COVID. Během pouhých pěti měsíců od zahájení očkování nashromáždil EudraVigilance 12 886 úmrtí v souvislosti s vakcínami COVID-19, z nichž téměř polovina (6 306) připadá na vakcínu Pfizer. Ve stejném časovém období VAERS zaznamenala celkem 4 406 úmrtí; z nich 91 % bylo spojeno s mRNA vakcínami, přičemž 44 % připadá na vakcíny Pfizer a 47 % na vakcíny Moderna.
Není možné zjistit, jaké procento všech úmrtí, k nimž dojde po očkování, bude skutečně nahlášeno do systému VAERS nebo EudraVigilance. Všimněte si však, že 4 406 úmrtí souvisejících s očkováním vakcínou COVID, které VAERS zaznamenala jen za posledních 5 měsíců, převyšuje kumulativní součet všech ostatních vakcín dohromady za celých předchozích 20 let. Je tedy zřejmé, že tyto vakcíny jsou zdaleka nejsmrtelnějšími v historii – zcela předvídatelně, a to vše u onemocnění, jehož úmrtnost nepřesahuje úmrtnost chřipky [Brown2020, Ioannidis2020].
3.1.3.2 Závažné příhody související s poruchou srážlivosti krve. Litanie diagnóz v obou databázích, které ukazují na patologickou aktivaci srážení krve, je téměř nekonečná – srdeční infarkty, mozkové mrtvice, trombózy v mozku a v jiných orgánech, plicní embolie; ale také trombocytopenie a krvácení, které jsou důsledkem nadměrné spotřeby trombocytů a koagulačních faktorů při diseminované intravaskulární koagulaci. Tyto mechanismy onemocnění způsobily mnoho výše shrnutých úmrtí; v jiných případech způsobily těžké akutní onemocnění, které po sobě v mnoha případech zanechá těžké postižení.
3.1.3.3 Jiné závažné reakce. Mezi závažné reakce patří také záchvaty, jiné neurologické příznaky, zejména související s motorickým ovládáním, a těžký systémový zánět s poškozením více orgánů. U mnoha těchto pacientů je opět vysoce pravděpodobné dlouhodobé nebo dokonce trvalé reziduální poškození.
3.1.3.4 Závažné nežádoucí účinky u dospívajících. Ve věkové skupině 12-17 let již byla do systému EudraVigilance nahlášena dvě úmrtí pravděpodobně související s vakcínou Pfizer. Rovněž v této věkové skupině bylo zaznamenáno 16 případů myokarditidy, všechny u mužů, a 28 případů záchvatů u obou pohlaví, z nichž 3 byly hlášeny jako život ohrožující. Vyskytlo se také několik případů cévní mozkové příhody, infarktu myokardu a závažného zánětlivého onemocnění.
Počet nežádoucích účinků je sice mnohem nižší než u dospělých, ale to je dáno pouze tím, že v této věkové skupině byla dosud mnohem nižší míra očkování. Pokud by systematické očkování dospívajících dostalo zelenou, musíme očekávat, že tento počet rychle stoupne na úroveň, která se bude podobat počtu dospělých.
3.1.3.5 Potraty. Ke dni 21. června 2021 eviduje EudraVigilance 325 případů potratů u očkovaných těhotných žen. I když je obtížné určit, o kolik přesně očkování zvýší míru potratovosti, většinu těchto případů nahlásili zdravotníci, kteří zřejmě považovali souvislost s vakcínou přinejmenším za pravděpodobnou. Už jen tato série případů by byla dostatečným důvodem pro pozastavení očkování a prošetření.
3.1.3.6 Úmrtí kojených dětí. Ačkoli se to přímo netýká věkové skupiny, která je předmětem této žaloby a tohoto znaleckého posudku, je třeba zmínit, že VAERS i EudraVigilance obsahují hlášení o úmrtí kojených dětí krátce poté, co jejich matky dostaly vakcínu společnosti Pfizer.
V části 3.1.1.5 jsme se zabývali možností absorpce vakcíny do placenty a prsních žláz. Hlášené potraty a úmrtí novorozenců naznačují, že tato rizika je třeba brát velmi vážně a že společnost Pfizer jednala nedbale, když je nezkoumala v žádné ze svých hlášených předklinických a klinických studií.
3.2 Chybějící důkazy. Výše jsme viděli, že při klinických zkouškách a následném urychleném mimořádném schválení vakcíny společnosti Pfizer byly zanedbány významné pozitivní náznaky rizika, což mělo nešťastné, ale předvídatelné důsledky. Stejně usvědčující je seznam opomenutých potenciálních rizik, která měla být zkoumána v předklinických nebo klinických studiích, ale nikdy nebyla.
3.2.1 Správná farmakokinetika. V části 3.1.1.2 byly popsány některé experimenty týkající se distribuce náhradní vakcíny. Ačkoli tyto studie poskytly důležité a užitečné informace, je třeba poznamenat, že exprese spike proteinu namísto pravděpodobně inertního enzymu luciferázy by mohla ovlivnit distribuci v důsledku jeho zásahu do cévní integrity, a to i na krevní mozkové bariéře, a do srážlivosti krve. EMA a další regulační orgány měly trvat na tom, aby takové experimenty byly provedeny a zdokumentovány.
3.2.2 Lékové interakce. Zpráva EMA uvádí (strana 110):
Studie interakcí s jinými vakcínami nebyly provedeny, což je vzhledem k nutnosti použití vakcíny v nouzových situacích přijatelné.
Jelikož je zřejmé, že úmrtnost v důsledku COVID-19 je nízká (viz oddíl 1.1.1), a že tedy neexistuje žádná mimořádná situace, je třeba tento argument odmítnout jako účelový.
Imunosupresivní účinky BNT162b2 jsou patrné z poklesu počtu krevních lymfocytů u očkovaných osob a také z klinických pozorování herpes zoster (pásový opar), který vzniká reaktivací perzistentního viru varicella-zoster [Furer2021]. To naznačuje, že může dojít k narušení žádoucí imunitní odpovědi na jiné současně podané vakcíny.
Studie interakcí se navíc neměly omezovat pouze na vakcíny, ale měly být rozšířeny i na další léčiva. Jednou z oblastí, která vzbuzuje obavy, je experimentálně zjištěná jaterní toxicita BNT162b2. Játra hrají ústřední roli v metabolické inaktivaci a likvidaci mnoha léčiv; jakýkoli zásah do funkce tohoto orgánu okamžitě vytváří četné možnosti nežádoucích lékových interakcí.
3.2.3 Genotoxicita. Nebyly provedeny žádné studie týkající se genotoxicity, tj. poškození lidského genetického materiálu, které by mohlo vést k dědičným mutacím a rakovině.
Ve zprávě EMA [Anonym2021f] je tato skutečnost odůvodněna následovně:
Nebyly předloženy žádné studie genotoxicity. To je přijatelné, protože složky vakcíny jsou lipidy a RNA, u nichž se neočekává genotoxický potenciál. Z hodnocení rizik provedeného žadatelem vyplývá, že riziko genotoxicity spojené s těmito pomocnými látkami [tj. syntetickými lipidy] je na základě literárních údajů velmi nízké.
Ve skutečnosti je známo, že LNP obsažené v BNT162b2 mohou vstupovat do všech druhů buněk – to je ostatně účelem jejich zařazení do tohoto vakcinačního přípravku.
Je také známo, že po vstupu do buňky kationtové lipidy narušují funkci mitochondrií (buněčné dýchání) a způsobují oxidační stres, který následně vede k poškození DNA.
Je třeba zmínit, že dva z lipidů použitých společností Pfizer – kationický lipid ALC0315 a PEGylovaný lipid ALC-0159, které tvoří 30-50 %, resp. 26 % celkového obsahu lipidů – nebyly dříve schváleny pro použití u lidí. Lehkovážný přístup společností Pfizer a EMA k používání nových a dosud neověřených chemických látek jako složek léčivých přípravků nebo vakcín bez komplexních studií toxicity, včetně genotoxicity, je zcela nevědecký a nepřijatelný.
3.2.4 Toxicita pro reprodukci. Reprodukční toxicita byla hodnocena pouze u jednoho druhu (potkani) a pouze na malém počtu zvířat (21 vrhů). Bylo zaznamenáno více než dvojnásobné zvýšení preimplantačních ztrát embryí s mírou 9,77 % ve skupině s vakcínou ve srovnání s 4,09 % v kontrolní skupině. Namísto pouhého konstatování [Anonym2021f], že vyšší hodnota byla „v rozmezí historických kontrolních údajů“, měla studie jednoznačně uvést, zda je tento rozdíl statisticky významný; a pokud není, měl být zvýšen počet pokusů, aby byla zajištěna požadovaná statistická síla. Totéž platí pro pozorování „velmi nízkého výskytu gastroschízy, malformací úst/čelistí, pravostranného aortálního oblouku a abnormalit krčních obratlů“. Celkově jsou tyto studie nedostatečně popsány a zřejmě byly také nedostatečně provedeny.
3.2.5 Autoimunita. Vystavení vakcíně povede k poškození buněk vlivem kationtových lipidů a také k imunitnímu útoku na buňky produkující spike protein. Z buněk, které procházejí destrukcí, se uvolní proteiny a další makromolekuly; tento materiál pak musí být odstraněn makrofágy.
Pokud je očistný systém přetížen v důsledku nadměrného poškození buněk a apoptózy (buněčné smrti), pak hromadění buněčných zbytků vede k chronicky nadměrnému uvolňování interferonu typu I, což následně vyvolá další zánět. Časem se některé makromolekuly v pozůstatcích stanou cílem pro tvorbu autoprotilátek a aktivaci autoreaktivních cytotoxických T-buněk – začnou fungovat jako autoantigeny. To pak vede k dalšímu poškození tkání a uvolnění dalších autoantigenů – vznikne autoimunitní onemocnění. Takový výsledek je obzvláště pravděpodobný u osob se sníženou imunitou nebo u osob, které jsou k autoimunitnímu onemocnění geneticky predisponovány (např. osoby s alelou HLA-B27).
Riziko autoimunity vyvolané přípravkem BNT162b2 by mohly adekvátně posoudit pouze dlouhodobé studie; stejně jako v případě plodnosti nebo rakoviny znamená velmi krátká doba preklinického a klinického testování, že jsme na slepé koleji. Mělo by být samozřejmé, že všechna tato rizika jsou obzvláště závažná u dětí, dospívajících a mladých dospělých.
3.2.6 Zlepšení závislé na protilátkách. Ačkoli protilátky v zásadě slouží k ochraně před infekcemi, v některých případech mohou zvyšovat závažnost onemocnění. Tento jev se označuje jako zesílení závislé na protilátkách.
3.2.6.1 Princip. V části 2.1.3.1 výše jsme viděli, že protilátky mohou, ale nemusí neutralizovat virus, který je vyvolal. Zatímco ve většině případů nejsou neutralizující protilátky škodlivé, u některých virů mohou situaci ve skutečnosti zhoršit tím, že usnadňují vstup těchto virů do hostitelských buněk. K tomu dochází proto, že určité buňky imunitního systému mají mikroby označené protilátkami přijímat a ničit je. Pokud taková buňka přijme částici viru, na kterou se navázaly protilátky, ale pak se jí podaří vyhnout zničení, může se místo toho začít v této buňce množit. Celkově pak protilátka posílí replikaci viru. Z klinického hlediska může toto zesílení závislé na protilátkách (ADE) způsobit hyperzánětlivou reakci („cytokinovou bouři“), která zesílí poškození plic, jater a dalších orgánů našeho těla.
ADE se může vyskytnout jak po přirozené infekci, tak po očkování, a byla pozorována u několika rodin virů, včetně viru dengue, viru ebola, respiračního syncytiálního viru (RSV) a HIV [Tirado2003]. Důležité je, že ADE se vyskytuje také u koronavirů, a zejména u SARS, jehož původce je úzce příbuzný SARS-CoV-2. Pokusy o vývoj vakcín proti SARS opakovaně selhaly kvůli ADE – vakcíny sice vyvolaly tvorbu protilátek, ale když byla očkovaná zvířata následně napadena virem, onemocněla více než neočkované kontroly (viz např. [Tseng2012]).
3.2.6.2 SARS-CoV-2 a ADE. Možnost ADE v souvislosti s přirozenou infekcí virem SARSCoV-2 i s očkováním proti němu byla připuštěna [Negro2020]. Konkrétněji, ADE v důsledku protilátek proti hrotovému proteinu vyvolaných jinými kmeny koronavirů byla uváděna jako příčina zvláštního geografického rozložení závažnosti onemocnění v Číně [Tetro2020]. Experimentální výzkum potřebný k řešení této otázky však stále chybí, a to i po více než roce trvání pandemie.
U některých experimentálních vakcín proti SARS lze ADE zmírnit použitím adjuvans na bázi inulinu [Honda-Okubo2015]. Tento přístup by mohl být proveditelný pro zamezení ADE také u vakcín COVID-19, ale zatím se zdá, že to nebylo zkoumáno u žádné ze stávajících vakcín COVID.
Společnost Pfizer a regulační orgány jsou si rizika ADE dobře vědomy. FDA ve svém informačním dokumentu [Anonymous2020] uvádí:
Společnost Pfizer předložila plán farmakovigilance (PVP) pro sledování bezpečnostních problémů, které by mohly být spojeny s vakcínou Pfizer-BioNTech COVID-19. Sponzor identifikoval jako důležité potenciální riziko zvýšené onemocnění spojené s vakcínou, včetně zvýšeného onemocnění dýchacích cest spojeného s vakcínou.
Termín „zvýšená nemoc spojená s očkováním“ se zde vztahuje na ADE. Agentura EMA rovněž uznala, že toto riziko musí být dále zkoumáno [Anonymous2021f]:
Měla by být zohledněna veškerá významná potenciální rizika, která mohou být specifická pro očkování proti COVID19 (např. zvýšené respirační onemocnění spojené s očkováním). Žadatel zahrnul VAED/VAERD jako důležité potenciální riziko a bude jej dále zkoumat v probíhající klíčové studii a poregistrační studii bezpečnosti.
Celkově je zřejmé, že riziko ADE je teoreticky uznáváno, ale v praxi se neřeší. Vzhledem k četným důkazům o ADE u experimentálních vakcín proti SARS je to zcela nezodpovědné.
Překlad do češtiny: Radek PECH, David FORMÁNEK – KULOVÝ BLESK
























![PLANDEMIE 1: Skrytá agenda za Covid-19 [DOKUMENT - 1. ČÁST] ahaplandemic-movie](https://otevrisvoumysl.cz/wp-content/uploads/2020/05/ahaplandemic-movie-150x150.jpg)
![Dr. David Martin & Reiner Fuellmich: Žádný nový koronavirus (a varianty) tu nejsou [exkluzivní rozhovor] david martin](https://otevrisvoumysl.cz/wp-content/uploads/2021/07/david-martin-150x150.jpg)


